Vergleich: mpMRT-gezielte Biopsie versus TRUS-Standardbiopsie
Im Vergleich zwischen mpMRT beziehungsweise konsekutiver, gezielter Biopsie (mpMRT-Biopsie) und TRUS-basierter systematischer Biopsie (TRUS-SB) ergeben sich mehrere Unterschiede:
mpMRT-Biopsieverfahren erlauben eine bessere Visualisierung der Tumorfoci und weisen eine höhere Sensitivität im Vergleich zur TRUS-SB auf (77 vs. 53 %). Gleichzeitig ist die Spezifität beider Methoden (68 vs. 66 %) vergleichbar [1, 3, 4].
Ein Großteil der Prostatakarzinome tritt in der peripheren Zone der Drüse auf, allerdings ist nur ein Bruchteil der Karzinome im Ultraschall sichtbar. Daher ist eine gezielte Gewebeentnahme kaum möglich [5, 6]. Der anteriore, oberhalb der Harnröhre gelegene Abschnitt der Prostata wird deshalb nur selten per Biopsie aufgesucht. Gerade diese anterioren Tumore erfordern jedoch häufig eine gezielte Biopsie und tiefere Platzierung der Nadel. Die genaue Detektion und Probeentnahme solcher Läsionen ist mit der TRUS-SB nur schwer zu erreichen [7, 8].
Die Vorteile der besseren Visualisierung von potenziellen Prostatakarzinomherden durch die mpMRT-Biopsie zeigten sich in der multizentrischen, prospektiv randomisierten PRECISION-Studie. Hier konnte erstmals der direkte klinische Mehrwert für Patienten im klinischen Alltag belegt werden: In einer Kohorte von Patienten mit einer PSA-basierten Indikation zur Erstbiopsie ergab der Vergleich der beiden unterschiedlichen „Testverfahren“ – Standard- TRUS-SB versus mpMRT-Biopsie – eine Überlegenheit des mpMRT-gestützten Vorgehens. So wurden bei Einsatz des MRT im Rahmen der Prostatadiagnostik mehr klinisch signifikante Tumore mit GS ≥ 3+4 (38 vs. 26 %) und gleichzeitig weniger insignifikante Prostatakarzinome mit GS 3+3 (9 vs. 22 %) als beim konventionellen TRUS-basierten Vorgehen detektiert [2].
Da die aktive Überwachung (Active Surveillance, AS) für Niedrigrisikopatienten zunehmend an Bedeutung gewonnen hat und eine wichtige Therapieoption für diese Patientengruppe ist, spielt gerade bei der AS eine präzise Diagnosestellung im Rahmen von Re-Biopsien eine große Rolle. Eine Fehlklassifikation von AS-Patienten ist ein potenzielles Problem, das heißt, es wird beispielsweise nur ein kleiner Niedrigrisikotumor in der peripheren Zone per TRUS-Stanzbiopsie detektiert, ein zweiter, zum Beispiel anterior gelegener Hochrisikotumorherd in atypischer Lage hingegen wird übersehen und gefährdet den Patienten. In dieser Situation kann durch eine verbesserte mpMRT-Biopsie eine präzisere Diagnostik erreicht und die Fehlklassifizierung und das Verpassen des richtigen Therapiefensters vermieden werden [2, 5, 9].
mpMRT
Durch die T2-gewichteten, hochauflösenden morphologischen Sequenzen in Kombination mit weiteren funktionellen Darstellungen, wie diffusionsgewichtete Bildgebung („diffusionweighted imaging“, DWI) und dynamische Kontrastmittelverstärkung („dynamic contrast-enhanced [DCE] imaging“), konnte die Sensitivität der Prostatakarzinomdarstellung deutlich verbessert werden.
Magnetfeldstärke und Endorektalspule
Die mpMRT der Prostata kann sowohl mit Geräten der Magnetfeldstärke von 1,5 Tesla als auch 3 Tesla mit oder ohne Endorektalspule (ERC) durchgeführt werden. Da in unterschiedlichen multizentrischen Studien sowohl 1,5-Tesla- als auch 3-Tesla-Geräte unterschiedlicher Hersteller genutzt wurden, scheint nicht die reine Teslastärke des Geräts, sondern scheinen vielmehr die Konfiguration und die entsprechenden Einstellungen eine größere Rolle zu spielen [2, 14]. Die meisten Mitglieder des PI-RADS Steering Committee empfehlen aktuell 3-Tesla-Geräte mit einer Körper-Phased-Array- Spule [10]. Beide Verfahren, mit oder ohne ERC, erzielen gute Ergebnisse. Da die Anwendung der ERC vielfach als unangenehm empfunden wird und die Untersuchungszeiten und -kosten erhöhen kann, besteht eine signifikante Zurückhaltung gegenüber der ERC-MRT. Zudem kann die Verwendung einer ERC die Drüse verformen und somit zu Artefakten führen [10].
MRT-gestützte Biopsieverfahren
Unterschiedliche technische Möglichkeiten erlauben im Rahmen der Biopsie beispielsweise die Ultraschallbiopsienadel-Einheit im Bezug zur Prostata zu lokalisieren, beziehungsweise die Position der Nadel im dreidimensionalen Raum zu detektieren. Auch eine direkte Biopsie im MRT unter permanenter Kontrolle der Lokalisation ist möglich.
mpMRT-gestützte In-Bore-Biopsie
Während des Eingriffs wird der Patient direkt im MRT-Gerät in Bauchlage positioniert und es wird eine Präbiopsie-mpMRT durchgeführt. Aufeinanderfolgende mpMRT-Bilder während der Biopsie zur Bestätigung der Nadelposition folgen. Aufgrund des sehr hohen Zeit- und Personalaufwands und der daraus resultierenden Kosten wird die In-Bore-Biopsie nicht routinemäßig eingesetzt. Nach Arsov et al. ist sie außerdem im Vergleich zur mpMRT/Ultraschall-gestützten technikbasierten Fusionsbiopsie (FGB) mit größeren Schmerzen für die Patienten verbunden [4, 5, 15].
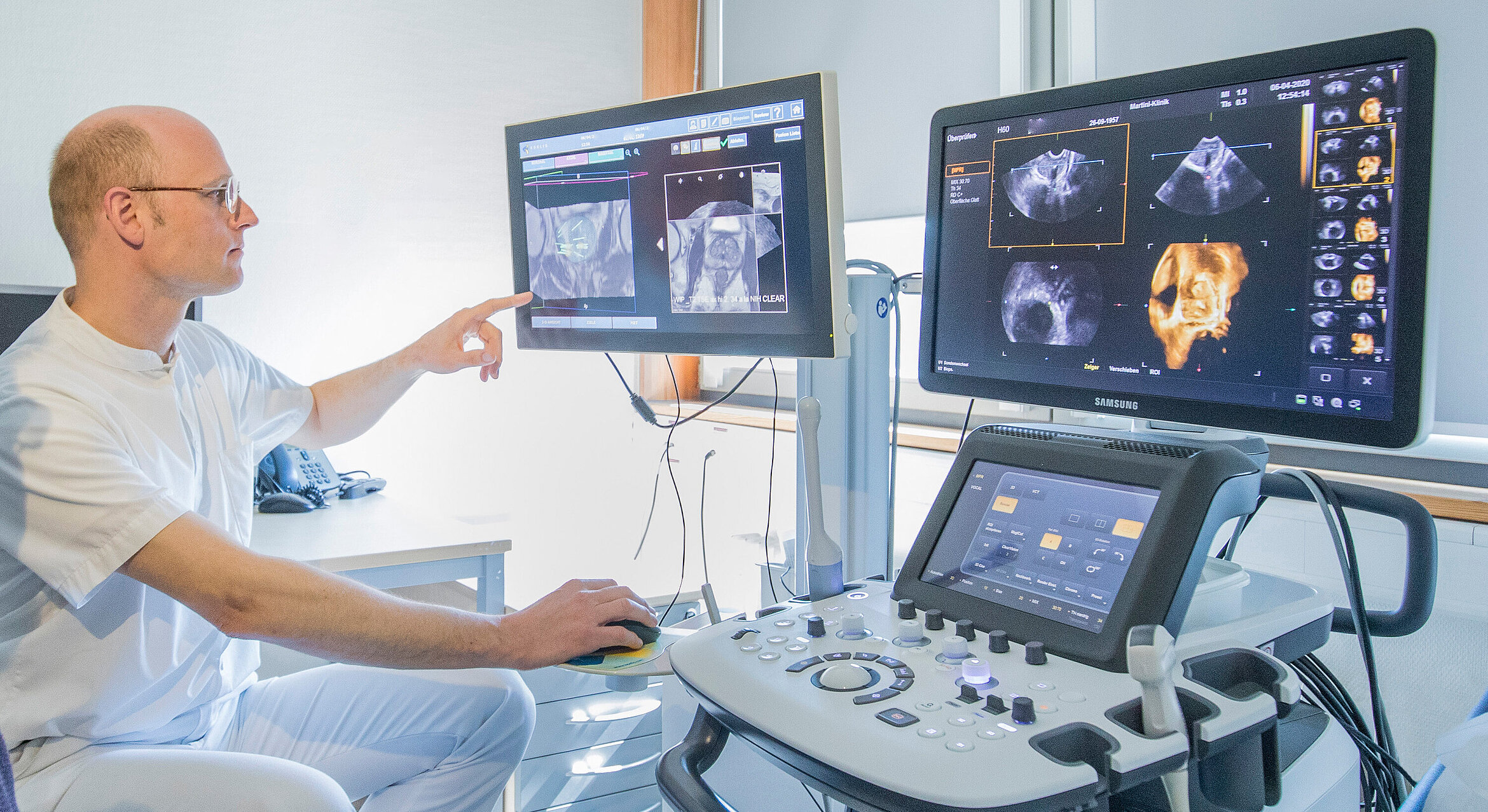
FGB
Bei der FBG werden Präbiopsie-MRT-Bilder mit Echtzeit-TRUS-Bildern fusioniert (Abb. 3). Dabei kann die Position der Nadel im 3-D-Raum verfolgt, aufgezeichnet und gespeichert werden [16, 17]. Es werden zwei Arten der Bildregistrierung unterschieden: rigide und elastische Fusion. Werden aufgezeichnete mpMRT- und TRUS-Bilder unverändert übereinandergelegt, spricht man von einer starren oder rigiden Registrierung. Beim elastischen Fusionsmodus werden Bilder aus mpMRT und TRUS computergestützt aufeinander angepasst. Auch bei der technischen Lokalisation der Prostata als Zielorgan und der Lokalisation der Biopsie/Ultraschalleinheit werden verschiedene technische Lösungen eingesetzt.